- 昭和医科大学
- 研究
- 倫理委員会
- 昭和医科大学における人を対象とする研究等に関する倫理委員会
- 倫理審査申請・利益相反申告の方法について
倫理審査申請・利益相反申告の方法について
このページは、倫理審査申請、利益相反申告のシステムでの申請方法のページになります。
電子申請システムは下記「システム」のボタンより利用できます。
申請方法や手順、様式につきましては「各種ご案内」をご参照ください。
倫理審査申請・利益相反申告システム
下記ボタンをクリックすると各システムのログイン画面に移動します。
※臨床研究の新規申請を行う場合は、倫理審査申請システムから先に申請を行ってください。
各種ご案内
下記メニューより、選択をしてください。
添付様式集
システム申請に加えて提出が必要な様式になります。下記「臨床研究の倫理審査申請に必要な書類一覧」を参照し、システム申請時に添付の上申請をお願いいたします。
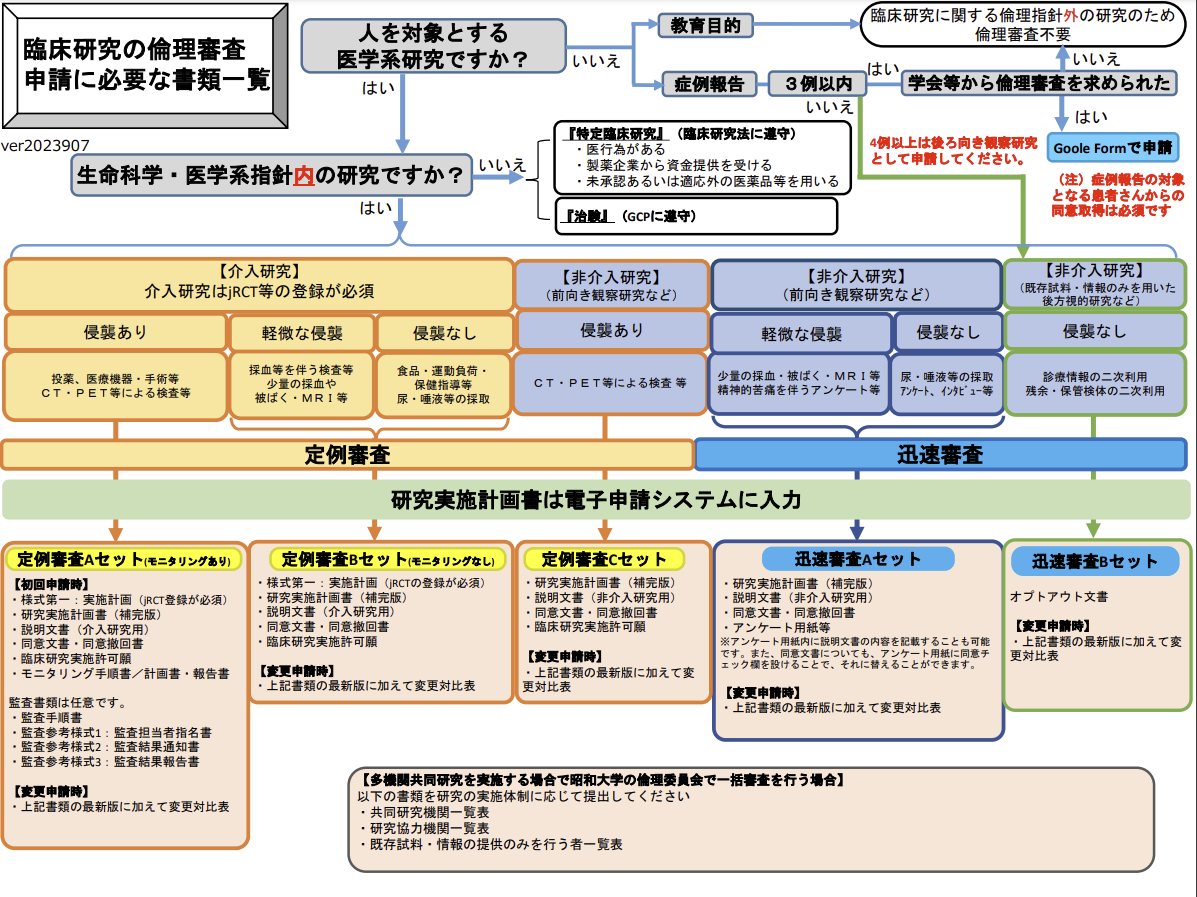
⇧⇧セットを選択してください⇧⇧
「臨床研究の倫理審査申請に必要な書類一覧」を参考に上のボタンでセットを選択すると下に必要書類が表示されます。
定例審査 Aセット
介入研究(侵襲あり)の場合
【初回申請時】
| 一括ダウンロード | 定例審査Aセット 一括ダウンロード |
| ・JRCTの申請画面のPDF ※申請はせず、一時保存の状態で提出をお願いいたします。 |
JRCTの申請画面で必要事項入力のの上、PDF化してください |
| ・研究実施計画書(補完版) | 研究計画書(補完版) |
| ・説明文書(介入研究用) | 説明文書テンプレート(介入研究用) |
| ・同意文書・同意撤回書 | 同意文書・同意撤回書 |
| ・臨床研究実施許可願 | 臨床研究実施許可願 |
| ・モニタリング手順書/計画書・報告書 | モニタリング手順書報告書・報告書 |
| ・割付指示・確認書(※任意で使用してください) | 割付指示・確認書 |
監査書類につきましては任意です。
| ・監査手順書 | 様式なし |
| ・監査参考様式1:監査担当者指名書 | 様式なし |
| ・監査参考様式2:監査結果通知書 | 様式なし |
| ・監査参考様式3:監査結果報告書 | 様式なし |
⇧⇧セットを選択してください⇧⇧
「臨床研究の倫理審査申請に必要な書類一覧」を参考に上のボタンでセットを選択すると下に必要書類が表示されます。
定例審査Bセット
介入研究(軽微な侵襲・侵襲なし)の場合
【初回申請時】
| 一括ダウンロード | 定例審査Bセット 一括ダウンロード |
| ・JRCTの申請画面のPDF
※申請はせず、一時保存の状態で提出をお願いいたします。 | JRCTの申請画面で必要事項入力のの上、PDF化してください。 |
| ・研究実施計画書(補完版) | 研究計画書(補完版) |
| ・説明文書(介入研究用) | 説明文書テンプレート(介入研究用) |
| ・同意文書・同意撤回書 | 同意文書・同意撤回書 |
| ・臨床研究実施許可願 | 臨床研究実施許可願 |
⇧⇧セットを選択してください⇧⇧
「臨床研究の倫理審査申請に必要な書類一覧」を参考に上のボタンでセットを選択すると下に必要書類が表示されます。
定例審査Cセット
非介入研究(侵襲ありの前向き観察研究など)の場合
【初回申請時】
| 一括ダウンロード | 定例審査Cセット 一括ダウンロード |
| ・研究実施計画書(補完版) | 研究計画書(補完版) |
| ・説明文書(観察研究用) | 説明文書テンプレート(非介入研究用) |
| ・同意文書・同意撤回書 | 同意文書・同意撤回書 |
| ・臨床研究実施許可願 | 臨床研究実施許可願 |
⇧⇧セットを選択してください⇧⇧
「臨床研究の倫理審査申請に必要な書類一覧」を参考に上のボタンでセットを選択すると下に必要書類が表示されます。
迅速審査Aセット
非介入研究(前向き観察研究など)の場合
【初回申請時】
| 一括ダウンロード | 迅速審査Aセット 一括ダウンロード |
| ・研究実施計画書(補完版) | 研究計画書(補完版) |
| ・説明文書(観察研究用) | 説明文書テンプレート(非介入研究用) |
| ・同意文書・同意撤回書 | 同意文書・同意撤回書 |
| ・アンケート用紙等 | 各自ご用意下さい |
また、同意文書についても、アンケート用紙上に同意チェック欄を設けることで、同意文書に替えることができます。
ご不明点があれば臨床研究支援課までご連絡ください。
⇧⇧セットを選択してください⇧⇧
「臨床研究の倫理審査申請に必要な書類一覧」を参考に上のボタンでセットを選択すると下に必要書類が表示されます。
迅速審査Bセット
非介入研究(既存試料・情報のみを用いた後方視的研究など)
【初回申請時】
| オプトアウト文書 | オプトアウト文書 |
【変更申請の場合】
上記セットの最新版の書類に加えて「変更対比表」の作成をお願いいたします。
| 研究計画内容変更の概要・変更対比表 | 研究計画内容変更の概要・変更対比表 |
【昭和医科大学の複数病院で実施する場合】
| 研究実施体制一覧 | 研究実施体制一覧(昭和医科大学内) |
【多機関共同研究(学外との共同研究)を行う場合】
| 共同研究機関一覧表 ※昭和医科大学の研究代表者が1部作成します。 審査方法(一括・個別)によらず、すべての共同研究機関についてご記載ください。個別審査となる機関は、審査方法で「個別審査」を選択します。 | 共同研究機関一覧表 |
| 共同研究機関研究者リスト(一括審査対象機関のみ提出) ※一括審査を希望する研究機関ごとに作成します(10機関あれば10部) 一括審査を希望する機関の研究責任者に作成を依頼し、すべての機関の書類が揃ったのちご提出ください。 ※ファイル名に施設名または共同研究機関一覧表の施設番号をつけてください。 ※共同研究機関一覧表の番号 には共同研究機関一覧表の施設ごとの番号を記載します。 ※個別審査対象の機関は提出不要です。 | 共同研究機関研究者リスト |
※旧指針(人を対象とする医学系研究に関する倫理指針)、ゲノム指針用
| 共同研究機関一覧表 | 共同研究機関一覧表(旧指針用) |
【研究協力機関がある場合】
| 研究協力機関一覧表 | 研究協力機関一覧表 |
【既存試料・情報のみ提供を行う機関がある場合】
| 既存試料・情報の提供のみを行う者一覧表 | 既存試料・情報の提供のみを行う者一覧表 |
【研究計画書入力準備シート】
| 倫理審査システムの下書きとしてご利用ください。 |
研究計画書入力準備シート |
倫理審査申請システムで新規申請をする際の入力項目一覧になります。
なお、各項目に入力時の注意事項が記載されておりますので、
電子申請システム入力前の事前準備や臨床研究アドバイザーへの相談の際にご活用ください。
(※倫理審査申請システムへの添付は不要です)
電子申請マニュアル
電子申請システムの使用方法及び項目の簡単な解説が記載されております。
① | 新規申請を行う場合 |
② | 申請後(審査前)に変更を行う場合 |
③ | 事務局からの訂正依頼に対する対応方法 |
④ | 変更申請を行う場合 |
⑤ | 審査結果通知書を確認・印字する場合 |
| ⑥ | 利益相反システムマニュアル |
計画書記載例
順次公開予定
| ① | 新規申請(介入研究(介入研究の場合・観察研究(侵襲あり))の場合 | 準備中 |
| ② | 新規申請(前向き非介入研究の場合)の場合 | 準備中 |
| ③ | 新規申請(後ろ向き観察研究など)の場合 |  |
| ④ | 他機関で一括審査を受けた研究の実施許可申請を行う場合 | 準備中 |
| ⑤ | 症例報告を行う場合 | 準備中 |
| ⑥ | 変更申請を行う場合(電子申請が始まる前に承認を得た研究) | 準備中 |
| ⑦ | 変更申請を行う場合(電子申請で審査を受け承認を得た研究) | 準備中 |
FAQ
+ボタンを押すと内容の確認ができます。
すべて開く +
研究全体に関すること
システム関連
学部生・大学院生は研究責任者や研究分担者になれますか?
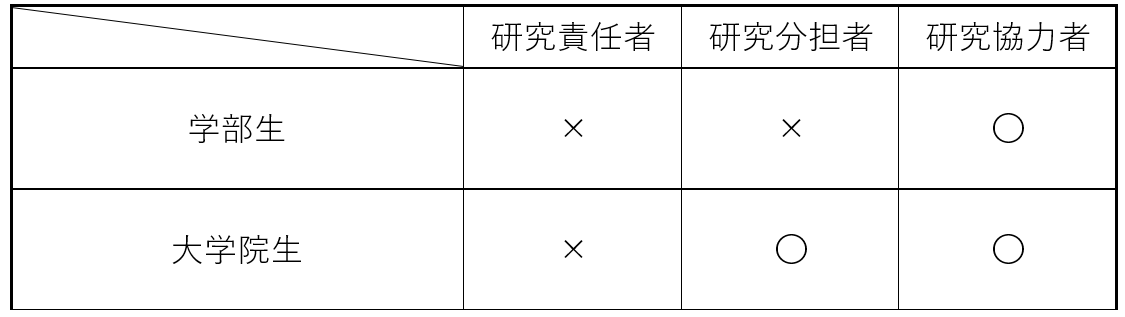 【学部生】 研究責任者や分担者になることはできません。研究協力者として研究への協力は可能です。 【大学院生】 研究責任者になることはできませんが、分担研究者、研究協力者になることはできます。 ※大学院生の場合は昭和医科大学の常勤職員の場合でも研究責任者にはなれません。 ※電子申請システムで研究協力者を登録する方法 項目4「その他研究に携わる者(昭和医科大学内)」で役割を「研究協力者」として該当者の登録をお願いいたします。 |
実施中の研究で「重篤な有害事象」または「重大な逸脱」と思われる事象が発生しました。どうしたらよいでしょうか。
研究責任者は、倫理委員会に報告が必要と判断された場合には、研究実施計画書に従って速やかに倫理審査申請システムで「有害事象報告」または「不適合報告」の入力をお願いいたします。ご不明な点がありましたら「こちら」までご連絡ください。連絡先はこちら
研究全体のデザインや統計解析について相談をしたい
「研究の相談」について
昭和医科大学には臨床研究アドバイザー制度を設け、各施設1名の担当がございます。
研究の相談がある際は臨床研究支援課までご連絡をください。
「統計解析」の相談について
データ管理室では臨床研究の統計解析を主とする研究相談や研究データの信頼性確保(モニタリング等)のための支援業務を行っております。
下記アドレスまでご連絡をください。
メールアドレス:surac-dc@ofc.showa-u.ac.jp
昭和医科大学には臨床研究アドバイザー制度を設け、各施設1名の担当がございます。
研究の相談がある際は臨床研究支援課までご連絡をください。
「統計解析」の相談について
データ管理室では臨床研究の統計解析を主とする研究相談や研究データの信頼性確保(モニタリング等)のための支援業務を行っております。
下記アドレスまでご連絡をください。
メールアドレス:surac-dc@ofc.showa-u.ac.jp
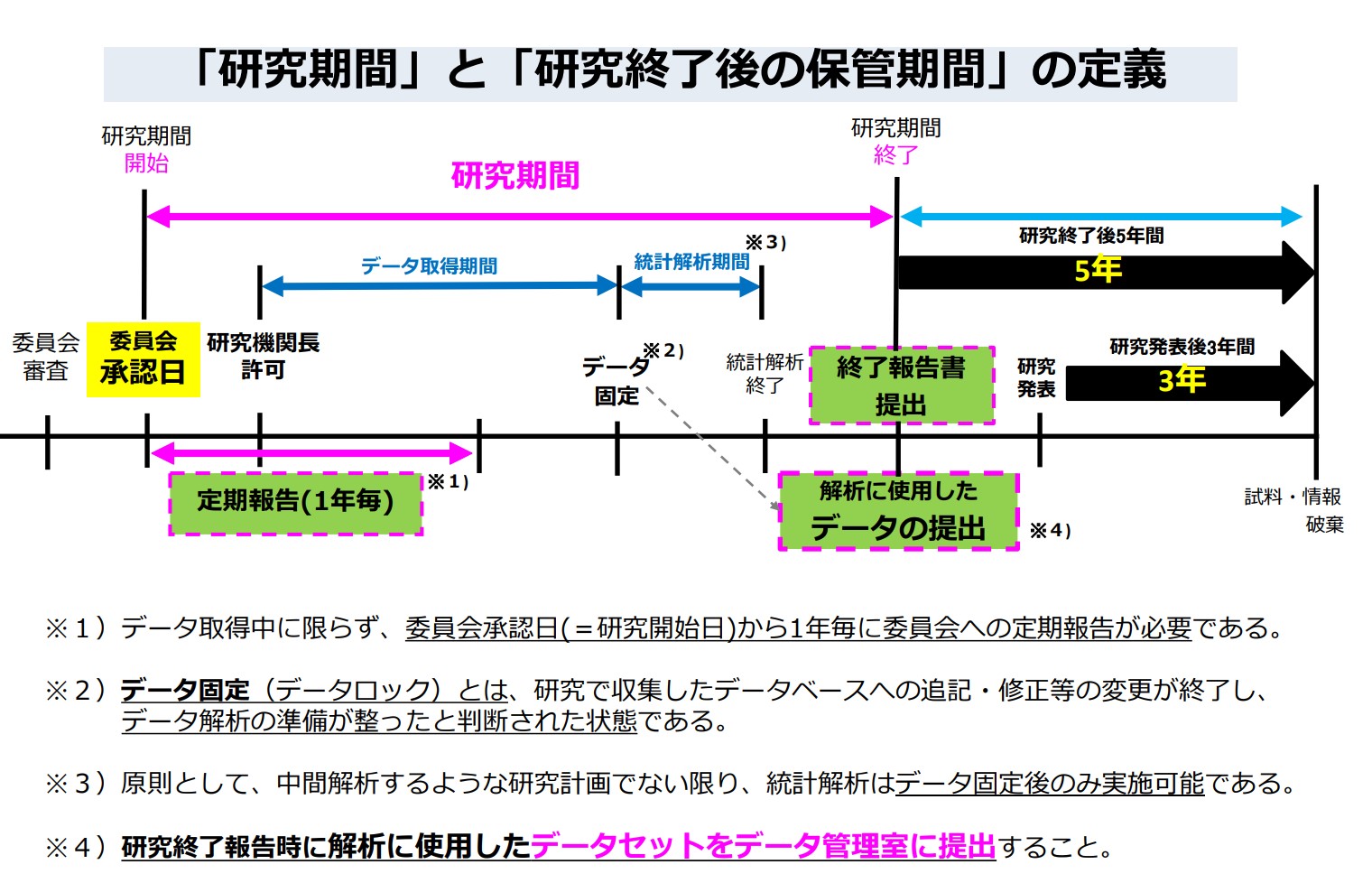
研究終了報告書はいつ提出したらよいですか?
研究計画書に記載された統計解析が完了した時点です。
なお、終了報告書の「研究結果の概要」にその結果を記載し、事務局が受理した段階で研究終了となります。
なお、終了報告書の「研究結果の概要」にその結果を記載し、事務局が受理した段階で研究終了となります。
研究終了後、解析方法が変わった場合は変更申請が必要ですか?
不要です。

定期・終了報告、変更申請を行いたいが、該当の研究が表示されない。または表示されてはいるが申請が出来ない。
ログイン時に必要な認証の職員IDまたはパスワードがわかりません。
職員ID及びパスワードは統括研究推進センターで確認することはできません。
総合情報管理センターにお問い合わせください。
https://www.showa-u.ac.jp/internal/network-journal/showa-id/password.html (総合情報センター「パスワード変更・不明の場合は」(学内サイト))
総合情報管理センター
TEL:03-3784-8651
Mail:itcenter@ic.showa-u.ac.jp
総合情報管理センターにお問い合わせください。
https://www.showa-u.ac.jp/internal/network-journal/showa-id/password.html (総合情報センター「パスワード変更・不明の場合は」(学内サイト))
総合情報管理センター
TEL:03-3784-8651
Mail:itcenter@ic.showa-u.ac.jp
倫理審査システムにログインができません
以下の3点が想定されます
①昭和医科大学の職員ID、パスワード、メールアドレス(@○○○.showa-u.ac.jp)をお持ちでない方
②「ユーザーが閉鎖されています」と表示された場合
③ログインIDまたはパスワードが異なる場合
①昭和医科大学の職員ID、パスワード、メールアドレス(@○○○.showa-u.ac.jp)をお持ちでない方
昭和医科大学の職員のみ申請が出来ますので、昭和医科大学の職員ID、パスワード、メールアドレス(@○○○.showa-u.ac.jp)をお持ちでない方は申請が出来ません。
②下記の画像のように「ユーザーが閉鎖されています」と表示された場合
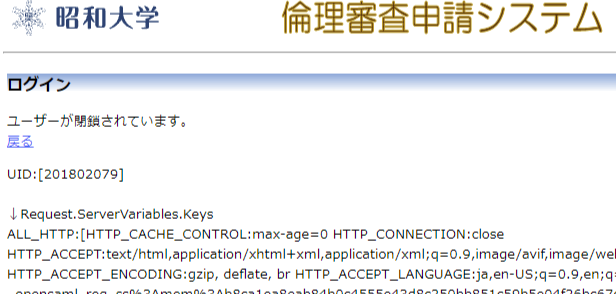
新たにユーザー登録手続きが必要です。ログイン画面の 「※ログインできなかった場合は、こちらで登録申請をしてください。」から申請を行ってください。
③ログインIDまたはパスワードが異なる場合正しいIDとパスワードを入力してください。IDやパスワードがわからない場合はこちらをクリックしてください
①昭和医科大学の職員ID、パスワード、メールアドレス(@○○○.showa-u.ac.jp)をお持ちでない方
②「ユーザーが閉鎖されています」と表示された場合
③ログインIDまたはパスワードが異なる場合
①昭和医科大学の職員ID、パスワード、メールアドレス(@○○○.showa-u.ac.jp)をお持ちでない方
昭和医科大学の職員のみ申請が出来ますので、昭和医科大学の職員ID、パスワード、メールアドレス(@○○○.showa-u.ac.jp)をお持ちでない方は申請が出来ません。
②下記の画像のように「ユーザーが閉鎖されています」と表示された場合

新たにユーザー登録手続きが必要です。ログイン画面の 「※ログインできなかった場合は、こちらで登録申請をしてください。」から申請を行ってください。
③ログインIDまたはパスワードが異なる場合正しいIDとパスワードを入力してください。IDやパスワードがわからない場合はこちらをクリックしてください
変更申請をしたいのですが、対象の研究課題が表示されません。
・電子申請開始前に申請された研究の場合、研究は研究責任者のみ変更申請が可能になります。
研究責任者が当該研究の「申請者」に設定しますと申請が可能になります。
詳細は電子申請マニュアル「変更申請を行う場合」を参照ください。
研究責任者が当該研究の「申請者」に設定しますと申請が可能になります。
詳細は電子申請マニュアル「変更申請を行う場合」を参照ください。
倫理講習会が未受講で申請が出来ないと表示されます。どのように対応すればいいですか。
倫理講習会を受講していないと倫理審査申請が出来ません。倫理講習会を受講し、確認テストで10問中8問以上の正解で申請が可能になります。研究責任者は分担研究者等に未受講者がいた場合は受講するように指示をしてください。
URLは下記になります(学内サイト)
URL:https://www.showa-u.ac.jp/internal/ofc/surac/ (統括研究推進センター(学内サイト))
※倫理審査申請システムの反映は翌営業日の10時ごろとなりますのでご注意下さい。
URLは下記になります(学内サイト)
URL:https://www.showa-u.ac.jp/internal/ofc/surac/ (統括研究推進センター(学内サイト))
※倫理審査申請システムの反映は翌営業日の10時ごろとなりますのでご注意下さい。
症例報告を行いたいのですが、学会から倫理審査を求められました。どのように手続きを行えばよろしいのでしょうか。
こちらをご覧ください。症例報告の倫理審査について
他機関で一括審査される研究について、昭和医科大学での手続きを知りたい。
他機関で一括審査される場合も昭和医科大学で電子申請システムを用いた手続きが必要です。
詳細は多機関共同研究の一括審査手順と様式をご確認ください。
詳細は多機関共同研究の一括審査手順と様式をご確認ください。
定期・終了報告、変更申請を行いたいが、該当の研究が表示されない。または表示されているが申請が出来ない。
電子申請システム上で研究責任者が「申請者」を追加して頂く必要ございます。 追加方法は電子申請マニュアル「④変更申請を行う場合」8ページをご参照下さい。
電子申請マニュアルURLはこちら
電子申請マニュアルURLはこちら
申請書の審査状況の確認方法が知りたい。
各申請の申請履歴で、審査の進捗状況が確認可能です。
各申請のステータスについての詳細は下記表を参照ください

各申請のステータスについての詳細は下記表を参照ください
研究責任者が当該研究の他の研究分担者の利益相反の申告状況を確認することはできますか?
下記の2つの方法で確認が可能です。なお確認は研究責任者のみが可能です。
★倫理審査システムから確認する場合
①申請者用メニューから該当の研究の「表示」を選択
②「申請履歴」の「利益相反」の欄のリンクを選択し利益相反申告システムに移動します。(画像の下にも案内が続きます)

③利益相反申告システムにログインします。
④「申告書閲覧」の「この申請書を編集する」を選択
⑤STEP5「現在の各申告者記載状況」より審査状況を確認できます。

★利益相反申告システムから確認を行う場合
①申告者用メニューから該当の研究の「表示」を選択
②「申請履歴」の項目から「編集」を選択
③STEP5「現在の各申告者記載状況」より各分担研究者の申請状況を確認できます。
★倫理審査システムから確認する場合
①申請者用メニューから該当の研究の「表示」を選択
②「申請履歴」の「利益相反」の欄のリンクを選択し利益相反申告システムに移動します。(画像の下にも案内が続きます)
③利益相反申告システムにログインします。
④「申告書閲覧」の「この申請書を編集する」を選択
⑤STEP5「現在の各申告者記載状況」より審査状況を確認できます。
★利益相反申告システムから確認を行う場合
①申告者用メニューから該当の研究の「表示」を選択
②「申請履歴」の項目から「編集」を選択
③STEP5「現在の各申告者記載状況」より各分担研究者の申請状況を確認できます。
お問い合わせ先
統括研究推進センター 臨床研究支援課
TEL:03-3784-8129
Mail:倫理審査システム・倫理審査に関するお問い合わせ(特定臨床研究を除く)
m-rinri@ofc.showa-u.ac.jp
特定臨床研究に関するお問い合わせ
ura-ec@ofc.showa-u.ac.jp
統括研究推進センター 臨床研究支援課
TEL:03-3784-8129
Mail:倫理審査システム・倫理審査に関するお問い合わせ(特定臨床研究を除く)
m-rinri@ofc.showa-u.ac.jp
特定臨床研究に関するお問い合わせ
ura-ec@ofc.showa-u.ac.jp